前不久美国癌症研究协会(AACR)年会刚结束,本月ACSO 又在芝加哥召开。
ASCO 是美国临床肿瘤学会(American Society of Clinical Oncology)的缩写,与美国癌症研究协会(AACR)是癌症研究和治疗领域中最著名的两个组织。虽然这两个组织都致力于推进癌症研究和改善病人护理,但它们有不同的使命和目标。AACR主要侧重于癌症的基础研究,而ASCO则更侧重于临床研究和病人护理。AACR还拥有更广泛的成员基础,包括来自世界各地的科学家、医生、病人倡导者和其他健康专业人士。ASCO则更聚焦于美国的肿瘤治疗的专业人员。
大会摘要可在官网搜索:
Program Guide – ASCO Meeting Program Guid
PD-1/PD-L1联合疗法成为会议焦点
今年ASCO大会的不少看点与PD-1 PD-L1免疫联合疗法有关。
1. 默沙东的 Keytruda 用于非小细胞肺癌 (NSCLC) 的早期阶段
默沙东试图获得批准,用于可切除的 2 期、3A 或 3B 期非小细胞肺癌
第 3 阶段 KEYNOTE-671 试验的数据
4 月份发布的一项中期分析发现,该研究达到了其双重主要终点之一,即无事件生存期。
2. 君实生物的特瑞普利单抗(teripalimab)用于一线三阴性乳腺癌
PD1 抑制剂 TORCHLIGHT 试验的数据
2 月份发布的一线数据发现,与单独使用白蛋白结合型紫杉醇相比,该候选药物与白蛋白结合型紫杉醇联合使用可显著改善 IV 期或复发/转移性三阴性乳腺癌患者的无进展生存期
君实的toripalimab上市许可证申请目前正在接受美国FDA审查,预计可能会在第三季度获得批准。
3. 阿斯利康用于卵巢癌的 Imfinizi 和用于 NSCLC 的 Tagrisso
DUO-O 试验检查了 Imfinzi (durvalumab) 联合铂类化疗和 Avastin (bevacizumab) 治疗新诊断的卵巢癌
阿斯利康正在寻求扩大 Tagrissa (osimertinib) 的标签,将 IB-IIIA 期 EGFR+ NSCLC 纳入辅助治疗
4. 信达的信迪利单抗用于治疗鼻咽癌 CONTINUUM 试验的数据
该试验比较了PD-1抗体信迪利单抗联合化疗和放疗(CRT)与单纯化疗和放疗在治疗鼻咽癌患者中的疗效。
无进展生存期改善:79% vs 86%
总生存期无统计学差异。可能是因为该试验的随访时间还不够长,总生存期的差异还未显现;或是因为对于晚期鼻咽癌来说,无进展生存期的改善并不总能转化为总生存期的获益。
放化疗方案与头颈部鳞状细胞癌的随机对照试验疗效相同
免疫抗癌药物简介
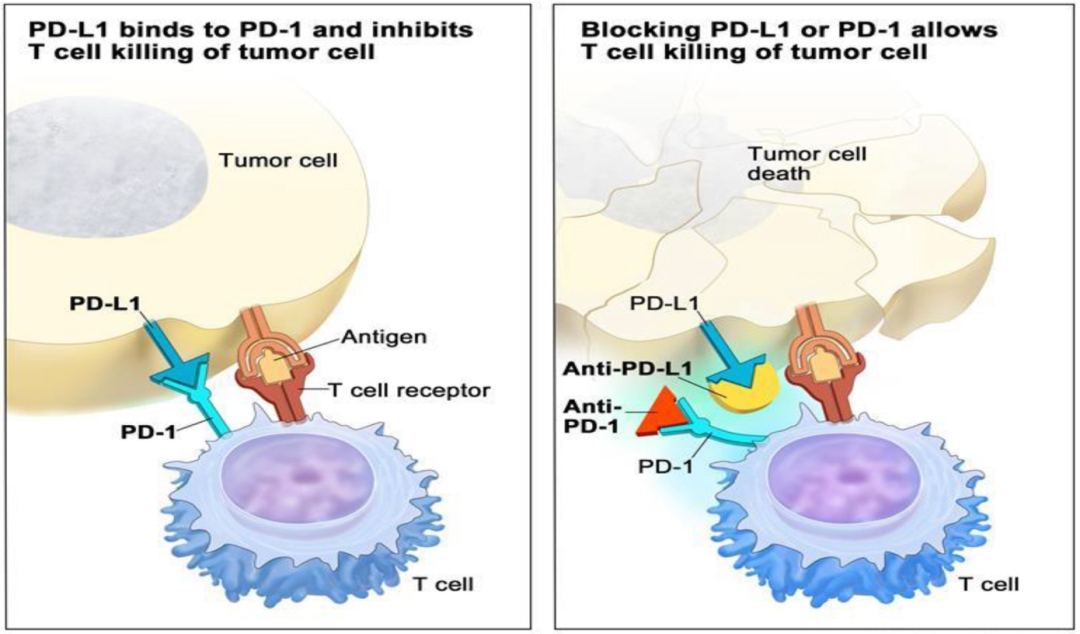
图1 著名的针对癌细胞“别吃我”信号通路的抑制药物机理。
图片来源:NCI科普网站https://www.cancer.gov/about-cancer/treatment/types/immunotherapy/checkpoint-inhibitors
PD-1抑制剂是一种免疫治疗药物,用于治疗多种癌症,如黑色素瘤、肺癌、肾癌、膀胱癌等。
PD-1抑制剂通过抑制PD-1和PD-L1之间的相互作用,从而增强T细胞的免疫应答,使T细胞能够识别和攻击癌细胞。目前,PD-1抑制剂已经被证明是一种有效的治疗方法,可以显著提高患者的生存率和生活质量 。
但这次ASCO大会的一个名为CONTACT-03的三期临床试验却发现:对于晚期肾癌患者,接受激酶抑制剂卡博替尼单药或联合PD-L1单抗阿替利珠单抗治疗,总体治疗效果无统计学差异。甚至联合治疗组的毒性大于单药组。
这些数据突出了需要对肾癌和其他肿瘤类型进行更多PD-1/PD-L1抑制剂联合用药必要性的研究。这项研究结果也发表在了柳叶刀最新一期上,这也是第一个显示TKI靶向药物联合PD- L1免疫抗癌药物对转移性肾细胞癌(mRCC)患者无益的三期临床试验。具体在下文介绍。
肿瘤免疫疗法或许无效
负面结果的临床试验和积极结果的试验一样重要。CONTACT-03研究就是一个很好的例子,它让我们总是过度乐观的科研人员冷静的地认识到,在临床实践中采用眼花缭乱的联合给药方案前,需要对免疫疗法进行进一步评估。

图2 柳叶刀同时发表了论CONTACT-03临床结果的论文
图片来源:柳叶刀杂志官网
CONTACT-03试验的具体结果表明,中位无进展生存期(PFS)在阿替利珠单抗联合卡博替尼组和该研究的单药卡博替尼组之间没有显著差异(10.6 vs 10.8个月;分层HR 1.03;P = .784)。因此,该研究未达到主要终点。两组的12个月PFS率分别为44%和48%。中期总生存期(OS)的分析也显示,两组之间没有差异,联合组的中位OS为25.7个月,单药组为21.1个月(HR 0.94;P = 0.690)。两组的12个月OS率分别为79%和76%。
虽然未发现任何特定的安全信号,但联合治疗与单药治疗相比毒性增加。CONTACT-03的结果同时发表在《柳叶刀》上。主持这项研究的托尼医生Toni K. Choueiri是一位黎巴嫩裔美国肿瘤医学家和研究人员。他是哈佛医学院教授,也是丹娜法伯癌症研究所兰克泌尿生殖肿瘤中心主任。
那么联合用药换成PD1 抑制剂会怎么样?让我们拭目以待正在进行的另一个临床试验TiNivo-2。这项试验将测试一种新的晚期肾细胞癌(aRCC)联合治疗方案。这是第一次评估一种独特的晚期肾细胞癌(aRCC)联合治疗方案的安全性和有效性。该试验旨在招募超过300名患者,涵盖近200个临床研究中心,比较tivozanib(最近批准的口服酪氨酸激酶抑制剂)与免疫治疗药物nivolumab联合使用与单独使用tivozanib的效果。
这项临床研究旨在确定两种已获批准用于aRCC的药物,tivozanib和nivolumab(O药),是否比单独使用tivozanib更有益。该试验还将确保同时服用两种药物仍然安全(基于TiNivo试验安全数据)。临床试验编号为NCT0498720。
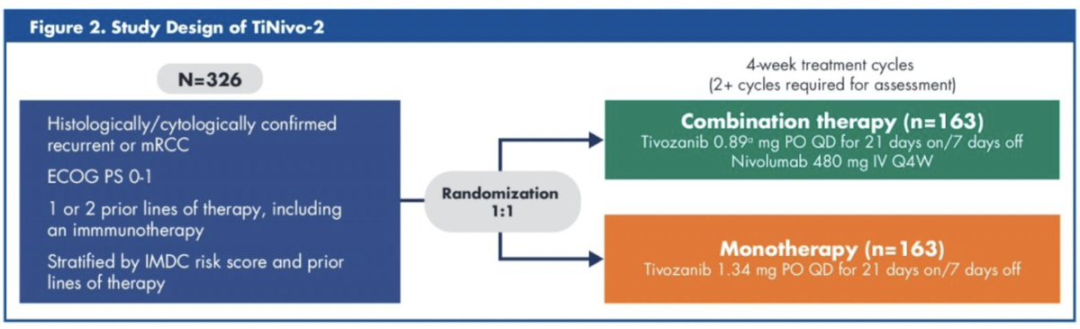
图3 TiNivo-2 临床试验设计
图片来源:托尼医生社交媒体
其实在临床上以PD-1/PD-L1抑制剂为代表的免疫抗癌药物对不同癌种的疗效千差万别。这是因为免疫抗癌药物需要癌细胞有较高水平的PD-L1表达和浸润性T细胞,这为PD-1抑制剂发挥作用提供了条件。
然而,在一些“冷癌症”如乳腺癌、卵巢癌和胰腺癌中,PD-1单抗的疗效较差。这是因为这些肿瘤的微环境中PD-L1表达较低和T细胞浸润较少,无法为PD-1单抗提供充足的靶点。
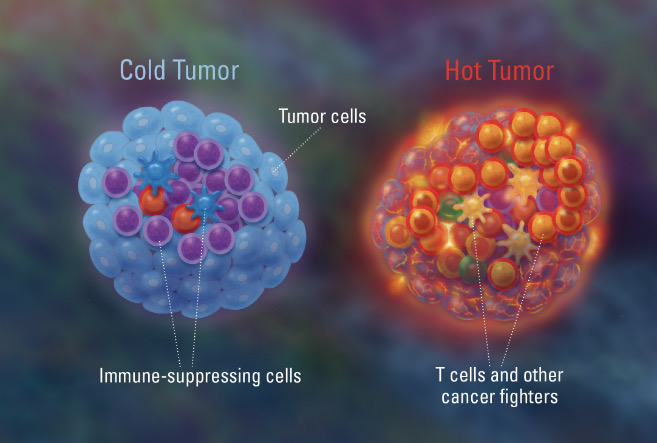
图片来源:哈佛大学研究所博客
要提高PD-1抑制剂在这些癌症中的疗效, 可考虑以下策略:
1. 由“冷”转“热”:具体方法
Immune priming,激活免疫反应的启动,比如,使用 Neoepitope Cancer Vaccine(提高肿瘤抗原表位的疫苗);
Modulating immune response,调节免疫反应的各种因素,比如,使用 TGF-β 抑制剂;
Expansion,促进细胞毒性 T 细胞的扩增,比如,使用白介素-15;
Recruitment,诱导细胞毒性 T 细胞向肿瘤方向迁移,比如,通过表观遗传调控药物或使用树突细胞或 T 细胞迁移的趋化因子;
Breaking tolerance,打破肿瘤对免疫的耐受性,比如使用 PD-1 和 PD-L1;
Immunogenicity,诱导免疫原性,比如,使用微卫星不稳定剂-MLH1 抑制剂;
Immunological cell death,诱导细胞死亡释放,比如,放化疗;
Adjuvanticity,辅助免疫反应,比如,溶瘤病毒。
2. 选择PD-L1高表达的亚群进行治疗。
3. 联合化疗或放疗,这可以增加肿瘤细胞死亡从而释放更多肿瘤抗原,吸引更多效应T细胞进入肿瘤组织。信达的PD-1单抗药物与化疗和放疗的联合用于鼻咽癌的III期CONTINUUM研究就是利用这一策略。
4. 除此之外最近学术界发现 YAP抑制剂或者TRYO3抑制剂可以联合PD-1抗体或肿瘤疫苗可显著增强免疫治疗效果。这也为新的临床试验设计提供了思路。
PD-1/PD-L1 类似靶点CD47-SIRPalpha值得关注
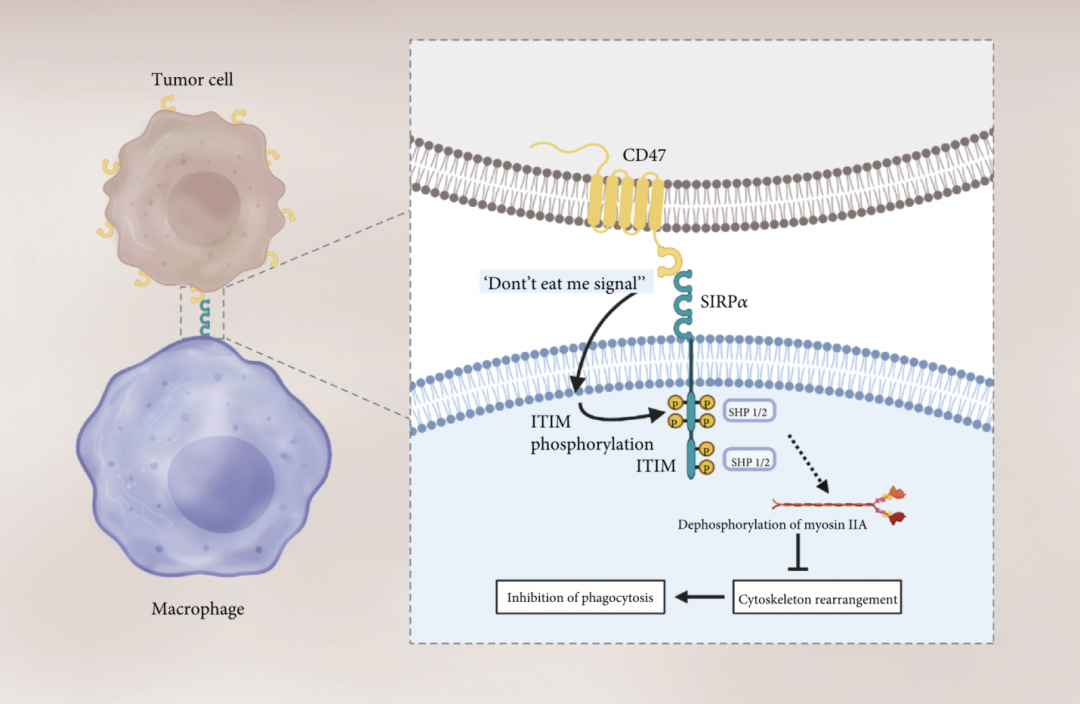
图5 CD47-SIRPalpha 信号通路
图片来源:参考文献12
当我们提到免疫检查点蛋白,通常会首先想到PD-L1/PD-1这一经典通路。它在抑制T细胞的适应性免疫反应中发挥重要作用。而CD47-SIRPα信号通路的功能与PD-L1/PD-1类似,也能抑制免疫细胞的反应,不同之处在于它抑制的是先天免疫系统中的巨噬细胞。
CD47就像是细胞表面的“别吃我”标签,它让巨噬细胞不会吞噬这些细胞。这种蛋白在所有正常细胞表面都有表达,是人体防止巨噬细胞“误伤”健康细胞的机制。
然而,许多肿瘤细胞会通过高表达CD47,帮助它们逃避巨噬细胞的吞噬。阻断这条“别吃我”通路,可能会恢复巨噬细胞的抗肿瘤免疫反应。这也使CD47-SIRPα信号通路成为抗癌药物研发的重要靶点。
与PD-L1/PD-1通路类似,CD47-SIRPα信号通路也是一条重要的免疫检查点通路。不同的是,它调节的是巨噬细胞而非T细胞的免疫反应。肿瘤细胞通过高表达CD47来逃避巨噬细胞的吞噬,阻断这条通路可能激活巨噬细胞的抗肿瘤活性,成为潜在的抗癌治疗靶点。
小 结
前段时间读《药物简史》发现从亚利山大大帝到华盛顿,都吃过没有循证医学苦。被放血疗法从肺炎到大出血短短几天衰弱致死。类似的古埃及使用柳木、无花果、椰枣、啤酒用来强化心脏,使用鳄鱼粪来避孕,使用水银来治疗梅毒,使用番红花中的秋水仙素来治疗痛风,以及从2世纪罗马的盖伦发扬光大,直至19世纪才逐渐没落的放血疗法。客观地说,并非所有药物都毫无疗效,但许多药物疗法的副作用远大于其疗效,只在特定场合有效却遭到滥用。
这次ASCO很受关注的两个临床试验结果也是再次证明循证医学的必要:和CONTACT-03类似,另一个PROSPECT 临床试验结果表明,对于近 1/3 的直肠癌患者,现在可以将放射疗法从治疗方案中移除。从病人角度来看,不仅免除了化疗造成的生活质量下降,还减少了不必要的开销。

图6 PROSPECT临床试验结果表明在局部晚期直肠癌患者中,新辅助治疗FOLFOX加选择性使用5-FU化学放射治疗(5-FU CRT)的效果不比5-FU CRT差。
图片来源:ASCO官网
参考资料:
1)CSCO、ASCO、ESMO……2021 重要学术会议盘点 | 肿瘤时间年度盘点 - 搜狐. https://www.sohu.com/a/513778919_121118854 Accessed 6/6/2023.
2) 全球ASCO CSCO ESMO肿瘤领域前沿进展 1.CSCO、ESMO两大学术盛会,带来 .... https://xueqiu.com/4866021334/200751485 Accessed 6/6/2023.
3)肿瘤学的代谢组学:看一看AACR 2023和ASCO 2023。https://www.metabolon.com/blog/metabolomics-in-oncology-aacr-asco/
4) PD-1/L1抑制剂在头颈部鳞状细胞癌治疗中的应用进展 - PMC. https://bing.com/search?q=PD-1%e6%8a%91%e5%88%b6%e5%89%82%e7%9a%84%e7%96%97%e6%95%88
5)一文读懂“抗癌神药”——PD-1抑制剂 - 知乎. https://zhuanlan.zhihu.com/p/225830747
6) PD-1 and PD-L1 inhibitors - Wikipedia. https://en.wikipedia.org/wiki/PD-1_and_PD-L1_inhibitors
7)骚死了,这死掉的肿瘤细胞 - 知乎 (zhihu.com)
8)JCI - TYRO3 induces anti–PD-1/PD-L1 therapy resistance by limiting innate immunity and tumoral ferroptosis
9)CONTACT-03: Randomized, open-label phase III study of atezolizumab plus cabozantinib versus cabozantinib monotherapy following progression on/after immune checkpoint inhibitor (ICI) treatment in patients with advanced/metastatic renal cell carcinoma. | Journal of Clinical Oncology (ascopubs.org)
10)Toni Choueiri, MD (@DrChoueiri) / Twitter
11)ASCO历届摘要搜索Program Guide – ASCO Meeting Program Guide
12)CD47-SIRPα Axis as a Biomarker and Therapeutic Target in Cancer: Current Perspectives and Future Challenges in Nonsmall Cell Lung Cancer https://doi.org/10.1155/2020/9435030
